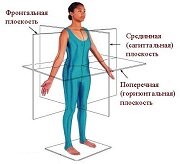
ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| ИССЛЕДОВАНИЕ СВЁРТЫВАЮЩЕЙ СИСТЕМЫ КРОВИ
Актуальность исследования состояния системы свёртывания крови во фтизиатрии обусловлена наличием у ряда больных туберкулёзом лёгких кровохарканий или лёгочных кровотечений. Кроме того, закономерно сопутствующая туберкулёзу латентно протекающая внутрисосудистая гемокоагуляция оказывает влияние на течение заболевания и эффективность химиотерапии. Для контроля за состоянием свёртывающей системы крови у больных туберкулёзом лёгких необходимо проводить определение активированного фибриногена, тромбинового времени, протромбинового индекса,времени кровотечения и времени свёртывания крови. ГОРМОНАЛЬНЫЕ ИССЛЕДОВАНИЯ Современные экспериментальные и клинические наблюдения свидетельствуют о наличии изменений гормонального статуса при специфическом туберкулёзном воспалении лёгких. Гистологическая верификация Наличие специфических туберкулезных изменений в материале, полученном при эндобронхиальной, трансторакальной биопсиях, биопсии плевры, торакоскопии, медиастиноскопии(томии), открытой биопсии легкого также является основанием для верификации диагноза туберкулеза. Полимеразная цепная реакция Присутствие ДНК МБТ можно установить в исследуемом материале с помощью полимеразной цепной реакции (ПЦР), которая в последние годы стала доступной и используется все шире. Метод обладает высокой чувствительностью – он позволяет обнаруживать возбудитель при содержании всего нескольких сотен микроорганизмов в 1 мл исследуемого материала (мокроты, крови, плеврального выпота и т.д.). Результат исследования можно получить в течение 5–6 ч. Однако существует ряд причин, препятствующих широкому использованию ПЦР для достоверной верификации диагноза туберкулеза. Предлагаемые отечественные и зарубежные модификации тест-систем для постановки ПЦР значительно различаются по чувствительности и специфичности, что не позволяет получать стандартизированный результат. Этот высокочувствительный метод в ряде случаев может давать ложноположительные результаты, что ограничивает достоверность исследования. ПЦР целесообразно применять в комплексе с традиционными методами лабораторной диагностики туберкулеза. При получении положительного ответа ПЦР, противоречащего результатам других исследований, желательно повторить постановку реакции [7]. Определение антител к МБТ Определение противотуберкулезных антител с помощью иммуноферментного анализа (ИФА) не имеет самостоятельного диагностического значения, что обусловлено недостаточной чувствительностью и специфичностью метода. В то же время значительное повышение уровня антител к МБТ в крови, определяемое количественным методом, является аргументом в пользу туберкулезной этиологии процесса при анализе результатов комплексного обследования.
МИКРОБИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ Микробиологические исследования необходимы при выявлении больных туберкулёзом, верификации диагноза, контроле и коррекции химиотерапии, оценке исходов лечения, другими словами, с момента регистрации больного туберкулёзом до снятия его с учёта. Все эпидемиологические программы и проекты основаны на оценке количества бактериовыделителей, что невозможно сделать без использования лабораторных методик выявления микобактерий туберкулёза. Традиционные микробиологические методы диагностики туберкулёза - бактериоскопическое и культуральное исследования. Современными методами считают культивирование микобактерий туберкулёза в автоматизированных системах, постановку ПЦР. Однако все эти методы обязательно сочетают с классическими бактериологическими методами. Микроскопия микобактерии Микроскопия мокроты — сравнительно быстрый, простой и недорогой метод, который должен быть использован во всех случаях при подозрении на туберкулёз. Кроме того, это исследование проводят для оценки эффективности химиотерапии и для констатации выздоровления или неудачного исхода лечения при отсутствии результатов культурального исследования. Используют 2 метода микроскопического исследования: • метод прямой микроскопии, когда мазок готовят непосредственно из диагностического материала; • метод микроскопии осадка, подготовленного из обработанного деконтаминантами материала для культурального исследования. Первый метод используют в тех лабораториях, где проводят только микроскопические исследования (клинико-диагностические лаборатории общей лечебной сети). Лучшие результаты микроскопического исследования получают при концентрировании диагностического материала (например, центрифугированием). Чтобы обнаружить микобактерии туберкулёза с вероятностью 50% при проведении микроскопии, 1 мл мокроты должен содержать более 5000 микробных клеток. Мокрота пациентов с лёгочными формами туберкулёза обычно содержит значительное количество кислотоустойчивых бактерий, что позволяет уверенно выявить их при бактериоскопии. Диагностическую чувствительность этого метода можно повысить, если исследовать несколько образцов мокроты от одного пациента. Отрицательный результат бактериоскопического исследования не исключает диагноза туберкулёза, поскольку мокрота некоторых пациентов содержит меньше микобактерии, чем можно выявить с помощью микроскопии. Плохая подготовка мазков мокроты также может быть причиной отрицательного результата бактериоскопического исследования. Наиболее распространённый метод для выявления кислотоустойчивых микобактерии в мазке — окраска по Цилю-Нельсену. Метод основан на проникновении карболового фуксина в микробную клетку через мембрану, включающую в себя вос-ково-липидный слой, при одновременном воздействии нагревания и сильного протравливающего действия фенола. Последующее обесцвечивание мазка 25% раствором серной кислоты или 3% солянокислым спиртом приводит к обесцвечиванию всех некислотоустойчивых структур. Обесцвеченные элементы мазка докрашивают 0,3% раствором метиленового синего. Микобактерий не воспринимают обычные анилиновые красители, в результате чего кислотоустойчивые микобактерий окрашиваются в малиново-красный цвет, а другие микробы и клеточные элементы — в голубой. Для исследования мазков, окрашенных по Цилю-Нельсену, используют световой бинокулярный микроскоп с иммерсионным объективом (90- или 100-кратное увеличение) и окуляром с 7- или 10-кратным увеличением. Исследуют 100 полей зрения, что достаточно для выявления в мазке единичных микобактерий. В том случае, если результат такого исследования отрицательный, для подтверждения рекомендуют просмотреть еще 200 полей зрения. Регистрируют результаты, указывая количество обнаруженных кислотоустойчивых микобактерий (КУМ). Микроскопия окрашенных по Цилю – Нильсену мазков патологического материала (при ТБЛ это, как правило, мокрота) и его посев на питательные среды (культуральное исследование) являются самыми распространенными и доказательными методами микробиологической диагностики ТБ.
Помимо данной методики, применяют окраску флюорохромами для люминесцентной микроскопии, что позволяет достичь наилучших результатов. Применение этого метода повышает эффективность микроскопии на 10-15%. При обработке микобактерий люминесцентными красителями (аурамин, родамин и др.) эти вещества также связываются с воскоподобными структурами микробной клетки. При облучении окрашенных клеток возбуждающим источником света (определённый спектр ультрафиолетового излучения) они начинают светиться оранжевым или ярко-красным светом на чёрном или тёмно-зелёном фоне. В связи с высокой яркостью и контрастностью видимого изображения можно снизить общее увеличение микроскопа в 4-10 раз, чем расширяется поле зрения и уменьшается время просмотра препарата. Наряду с этим за счёт значительно большей глубины резкости можно повысить комфортность исследования. К недостаткам метода флюоресцентной микроскопии относят сравнительно высокую стоимость микроскопа и его эксплуатации. Однако в централизованных или других крупных лабораториях, где нагрузка превышает норму 3 лаборантов, работающих с тремя обычными микроскопами, дешевле использовать вместо этого один флюоресцентный микроскоп. Бактериоскопические методы обладают довольно высокой специфичностью (89-100%). Около 97% положительных результатов, полученных любым методом микроскопии, однозначно подтверждаются результатами посева. Необходимо отметить, что при микроскопическом исследовании мазка патологического материала нельзя определить видовую принадлежность выявленных кислотоустойчивых микобактерии. Метод микроскопии позволяет дать заключение лишь о наличии или отсутствии в препарате кислотоустойчивых микроорганизмов. |