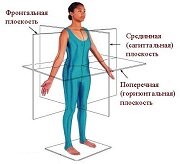
 ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Игровые автоматы с быстрым выводом Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ. ОБРАЗОВАНИЕ БИОГЕННЫХ АМИ-НОВ, ИХ РОЛЬ В РЕГУЛЯЦИИ МЕТАБОЛИЗМА И ФУНКЦИИ.
БИОХИМИЯ. 3 КОЛЛОК ПЕРЕВАРИВАНИЕ БЕЛКОВ. ВСАСЫВАНИЕ АМИНОКИСЛОТ. ДИНАМИЧЕСКОЕ СОСТОЯНИЕ БЕЛКОВ В ОРГАНИЗМЕ. АЗОТИСТЫЙ БАЛАНС. БИОЛОГИЧЕСКАЯ ЦЕННОСТЬ ПИЩЕВЫХ БЕЛКОВ В ПИТАНИИ. РЕГУЛЯЦИЯ ПИЩЕВАРЕНИЯ ГОР-МОНОПОДОБНЫМИ ВЕЩЕСТВАМИ. ВИДЫ КИСЛОТНОСТИ ЖЕЛУДОЧНОГО СОКА. Переваривание белков происходит в различных отделах пищеварительного тракта (в желудке, двенадцатиперстной кишке и тонком кишечнике) под действием протеолитических ферментов пищеварительных соков. Переваривание белков начинается в желудке под действием Ферментов желудочного сока. В сутки выделяется от 1,5 до 2,5л сока, который отличается от других пищеварительных соков сильно кислой реакцией. рН его 0,9-1,6 благодаря присутствию свободной соляной кислоты, секретируемой обкладочными клетками слизистой желудка. Секреция соляной кислоты в полость желудка представляет активный транспорт, осуществляемый протонной АТФ-азой с затратой АТФ и благодаря наличию в клетках карбоангидразы. Процесс сопровождается уменьшением количества хлоридов в крови. Роль соляной кислоты: 1. вызывает денатурацию белков; 2. вызывает набухание труднорастворимых белков; 3. растворяет белки, растворимые в кислой среде; 4. активирует пепсиноген; 5. создает рН, необходимое для действия пепсина; 6. стерилизует пищу; 7. способствует всасыванию железа; 8. вызывает секрецию секретина в двенадцатиперстной кишке.
В желудочном соке содержатся протеолитические ферменты: пепсин, гастриксин, реннин. Главным из них является пепсин. Переваривание белков в кишечнике. Образовавшиеся в результате действия пепсина в желудке полипептиды и нерасщепившиеся белки поступают в двенадцатиперстную кишку, куда поступает и сок поджелудочной железы. Панкреатический сок имеет щелочную реакцию(рН 7,5-8,2), что обусловлено высоким содержанием бикарбонатов. В сутки выделяется до 800 мл сока. Кислое содержимое, поступающее из желудка, нейтрализуется, и пепсин теряет свою активность. В панкреатическом соке содержатся протеолитические ферменты: трипсин, химотрипсин, арбоксипептидаза и эластаза, которые вырабатываются в виде проферментов. Переваривание сложных белков начинается с отщепления простетической группы, которая в зависимости от химической природы подвергается дальнейшим ферментативным превращениям (например, нуклеиновые кислоты расщепляются панкреатическими РНК-азой и ДНК-азой). Белковая часть гидролизуется рассмотренными выше ферментами до аминокислот. Всасывание аминокислот происходит путем активного транспорта, т.е. идет с затратой АТФ, против градиента концентрации с участием переносчиков. Выяснено, что существуют специфические транспортные системы, переносящие аминокислоты определенного строения: 1. Нейтральные с небольшим радикалом. 2. Нейтральные с объемным радикалом. 3. Кислые (отрицательно заряженные). 4. Основные (положительно заряженные). 5. Пролин. В настоящее время расшифрован механизм транспорта аминокислот в клетки кишечника, мозга, почек, получивший название γ-глутамильного цикла. В нем участвуют 6 ферментов и трипептид глутатион. Ключевой фермент – гаммаглутамилтрансфераза (ГГТ) локализован в мембране. Он отщепляет глутаминовую кислоту от глутатиона и переносит ее поступающую в клетку аминокислоту с образованием дипептида. Он оказывается в клетке и расщепляется другим ферментом цикла. аминокислоту и оксопролин. Через ряд реакций оксопролин превращается в глутаминовую кислоту. Из нее, цистеина и глицина, выделившихся при расщеплении глутатиона, происходит ресинтез глутатиона, при этом на активацию каждой аминокислоты затрачивается АТФ,т.е. на ресинтез глутатиона – 3 АТФ. Судьба аминокислот Аминокислоты, всосавшиеся через стенку кишечника,поступают в кровь и по системе воротной вены попадают в печень, где используются с различными целями. Главные пути использования следующие: - Синтез структурных белков. - Синтез белков плазмы крови. - Синтез биологически активных веществ (ферментов, пуриновых и пиримидиновых нуклеотидов, аминов, креатина). - Распад аминокислот с использованием углеродного скелета для глюконеогенеза. - Значительная часть аминокислот с кровью поступает к органам и тканям. В тканях аминокислоты используются с такими же целями,кроме этого, в эндокринных железах синтезируются гормоны. В тканях, как и в печени, происходит распад аминокислот до СО2, Н2О и ΝН3. О состоянии обмена белков в организме судят по азотистому балансу, т.е. разнице между количеством азота,поступающего в организм,и количеством азота, выводимого из организма( с мочой и калом) в виде конечных продуктов обмена. Возможны три состояния азотистого баланса. Положительный азотистый баланс- состояние, при котором количество поступающего азота превышает количество выводимого из организма. Такое состояние характерно для детского возраста (у растущих организмов), беременности, периода выздоровления людей после перенесенных тяжелых заболеваний, спортсменов в период интенсивной тренировки. При таком состоянии азотистого баланса синтетические процессы превалируют над процессами распада белков органов и тканей. Отрицательный азотистый баланс- состояние, при котором количество азота, выделяемого из организма, превышает количество азота, принимаемого с пищей в течение суток.Оно встречается при голодании (частичном или полном), белковой недостаточности, тяжелых раневых и инфекционных заболеваниях, в норме в старческом возрасте. Старики, как правило, теряют в весе, хотя в организм может поступать достаточное количество белков. Азотистое равновесие - состояние, при котором количество вводимого с пищей азота равно количеству азота, выводимого из организма. Оно характерно для здорового взрослого человека,находящегося на полноценной диете. Природные белки в связи с разным аминокислотным составом имеют разную пищевую ценность.Чем ближе аминокислотный состав пищевого белка к аминокислотному составу белков человека,тем выше его биологическая ценность. Такими биологически ценными белками для человека являются белки мяса, молока, яиц. Исключение хотя бы одной незаменимой аминокислоты из пищи приводит к отрицательному балансу, остановке роста и развития, прекращению синтеза белков. Недостаточное поступление одной незаменимой аминокислоты ведет к неполно усвоению других аминокислот, а в последующем также может привести к остановке роста и тяжелым расстройствам.Растительные белки от животных отличаются другим соотношением аминокислот, и поэтому для удовлетворения потребностей человека в белках их требуется значительно больше. Важное значение в удовлетворении потребностей нашего организма в белках имеет способность белков пищи к усвоению, что зависит от способности протеолитических ферментов наших пищеварительных соков расщеплять их до аминокислот. Так, белки шерсти, перьев, волос имеют близкий аминокислотный состав к белкам человека,но не гидролизуются протеолитическими ферментами пищеварительных соков человека большинства животных. Регуляция пищеварения гормоноподобными веществами желудочно-кишечного тракта
Секреция пищеварительных соков находится под контролем сложных нейрогуморальных механизмов, среди которых важное место занимают гормоноподобные вещества желудочно-кишечного тракта. Секрецию желудочного сока стимулируют гастрин и гистамин. Гастрин – полипептид, вырабатываемый слизистой оболочкой привратника под действием пищи,попадающей в желудок.Секреция его, кроме химических факторов, стимулируется рефлекторным растяжением желудка пищей. Кровотоком гастрин доставляется в клетки слизистой желудка и стимулирует секрецию желудочного сока (воды, электролитов, ферментов). Гистамин – продукт декарбоксилирования гистидина– вызывает интенсивную секрецию желудочного сока, чем обусловлено его применение в клинике при исследовании функциональной активности слизистой желудка. Регуляция секреции панкреатического сока осуществляя секретином и холецистокинином. Оба они – полипептиды, синтезируемые слизистой оболочкой двенадцатиперстной кишки.При поступлении из желудка кислого содержимого стимулируется образование секретина(под влиянием соляной кислоты и других химических раздражителей).Он поступает с кровотоком в поджелудочную железу аденилатциклазную систему стимулирует секрецию ,богатогоска бикарбонатами и с большим содержанием воды. В ответ на поступление в двенадцатиперстную кишку жирной пищи клетками слизистой оболочкой вырабатывается холецистокинин,который кровью доставляется в поджелудочную железу и стимулирует выработку сока, богатого ферментами (поэтому его раньше называли панкреозимин). Он также вызывает сокращение гладких мышц желчного пузыря усиливает двигательную функцию кишечника.
2. ТРАНСАМИНИРОВАНИЕ АМИНОКИСЛОТ: ХИМИЗМ, ЗНАЧЕНИЕ. ХАРАКТЕРИ-СТИКА ТРАНСАМИНАЗ. НЕПРЯМОЕ ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ.
1)Путь синтеза в организме заменимых аминокислот.
2)Первый этап непрямого дезаминирования аминокислот. 3)Осуществление взаимосвязи аминокислот, углеводов и липидов
лотами: ПВК, ЩУК или a-кетоглутаровой. Образовавшиеся АЛА и АСП вновь вступают в переаминирование сa-кетоглутаровой кисло-той при участии специфических ферментов: аланинаминотрансферазы (АлАТ) и аспартат-аминотрансферазы (АсАТ).
3. ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ: ХИМИЗМ, ХАРАКТЕРИ-СТИКА ФЕРМЕНТОВ. ВОССТАНОВИТЕЛЬНОЕ АМИНИРОВАНИЕ АЛЬФАКЕТОГЛУ-ТАРАТА, ЗНАЧЕНИЕ. 1. Дезаминирование аминокислот.
У животных, растений и большинства бактерий дезаминирование происходит окислительным путем. Процесс идет с участием ферментов оксидаз.Выделены оксидазы L-аминокислот, превращающие L-изомеры аминокислот, и D-оксидазы.
L-оксидазы имеют простетическую группу ФМН,проявляют относительную и стереохимическую специфичность,мало активны
Аминокислоты наших белков и поступающих с пищей– L-ряда. D-аминокислоты могут поступить с некоторыми бактериями или всо-саться из кишечника, где под действием рацемаз микрофлоры может идти рацемизация L-аминокислот в D-изомеры. Из всех L-оксидаз следует выделить фермент глутаматдегидрогеназу, которая дезамини-рует глутаминовую кислоту и отличается тем, что:
1. Имеет кофермент НАД. Обладает абсолютной специфичностью.
2. Высоко активна. 3. Локализована в митохондриях.
4. Регуляторный фермент: активируется АДФ, ингибируется АТФ, ГТФ, эстрогенами, тироксином.
При дезаминировании глутаминовой кислоты образуетсяa-кетоглутарат.
Вывод: таким образом, из всех нашихL-аминокислот активно прямо дезаминируется только глутаминовая кислота. Восстановительное аминирование альфакетоглутарата.
В мышечной ткани этот процесс приводит к образо-ванию еще одной транспортной формы аммиака. При интенсивной
мышечной работе выделяющийся аммиак связываетсяa - с кетоглутаровой кислотой под действием глутаматдегидрогеназы. Образуется глутамат:
НАДФ×Н + Н+®НАДФ NН3 +a-кгглутаматдегидрогеназа ГЛУ
Глутаминовая кислота вступает в переаминирование с пируватом, образующимся при интенсивной мышечной работе в результате распада гликогена или глюкозы. Образующийся аланин является транспортной формой аммиака, доставляемой кровью в печень, где он вступает в переаминирование aс-кетоглутаратом, в результате чего получаются пируват и глутамат. Глутаминовая кислота через аспартат (пе-реаминирование со щавелевоуксусной кислотой)включает свою NН2-группу в мочевину. Пируват используется в глюконеогенезе для синтеза глюкозы, которая поставляется печенью мышцам. Этот механизм имеет важной значение для выведения аммиака из мышечной ткани и получил название глюкозо-аланинового цикла. ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ. ОБРАЗОВАНИЕ БИОГЕННЫХ АМИ-НОВ, ИХ РОЛЬ В РЕГУЛЯЦИИ МЕТАБОЛИЗМА И ФУНКЦИИ.
Декарбоксилирование - Превращения аминокислот по карбоксильной группе. В тканях животных процесс декарбоксилирования аминокислот протекает под действием декарбоксилаз с образованием аминов.
Декарбоксилазы аминокислот – сложные ферменты, коферментом которых является пиридоксальфосфат. Обнаружены процессы декарбоксилирования гистидина, триптофана, 5-гидрокситриптофана, тирозина, глутаминовой, аспарагиновой, цистеиновой кислот с образованием соответствующего амина: гистамина, триптамина, серотонина, тирамина, γ-аминомасляной кислоты, β-аланина, таурина. Их называют биогенными аминами, так как в малых дозах это биологически активные вещества с мощным фармакологическим действием, в больших дозах – фармакологические яды. Декарбоксилазы ароматических аминокислот, гистидина, глютаминовой кислоты и других не отличаются строгой специфичностью. Ферменты мало активны, и процесс протекает с малой скоростью. При декарбоксилировании тирозина образуется тирамин, проявляющий сосудосуживающее действие.
Н2N - CН - COOH Тирозин тирамин
Декарбоксилирование триптофана сопровождается образованием триптамина, также обладающего сосудосуживающим действием.
Триптофан триптамин
При декарбоксилировании производного триптофана - 5- гидрокситриптофана образуется 5- гидрокситриптамин или серотонин.
|


 Значение процесса переаминирования:
Значение процесса переаминирования: В тканях активно дезаминируется лишь глутаминовая кислота. Изучение азотистого обмена, активности ферментов привело к мысли, что дезаминирование большей части аминокислот идет непрямым пу-тем. Вначале аминокислоты вступают в переаминирование с кетокис-
В тканях активно дезаминируется лишь глутаминовая кислота. Изучение азотистого обмена, активности ферментов привело к мысли, что дезаминирование большей части аминокислот идет непрямым пу-тем. Вначале аминокислоты вступают в переаминирование с кетокис-



 ФМН (ФАД) + Н2О2
ФМН (ФАД) + Н2О2



